- Home
- fiberprotein
fiberprotein

ファイバープロテインとは?
ファイバープロテイン(線維状蛋白質)の種類
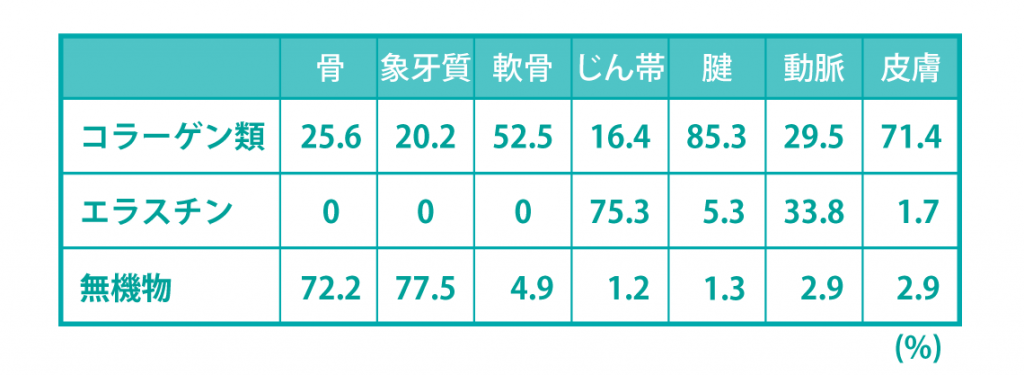
プロテインは、球状と線維状に分けられ、線維状にはコラーゲン、エラスチン、ミオシン、ケラチンなどがある。
弾力性・柔軟性・伸縮性の特徴があり、筋肉・筋膜・靭帯・腱・血管・骨・真皮の主要成分。
●コラーゲン
3重らせんのワイヤーの様な鋼性線維で、強靭性のもと。Ⅰ型~28種類に分類される。
●エラスチン
ゴムの様に伸び縮みする弾性線維で、コラーゲンとともに運動機能を左右する。

ファイバープロテインの特徴
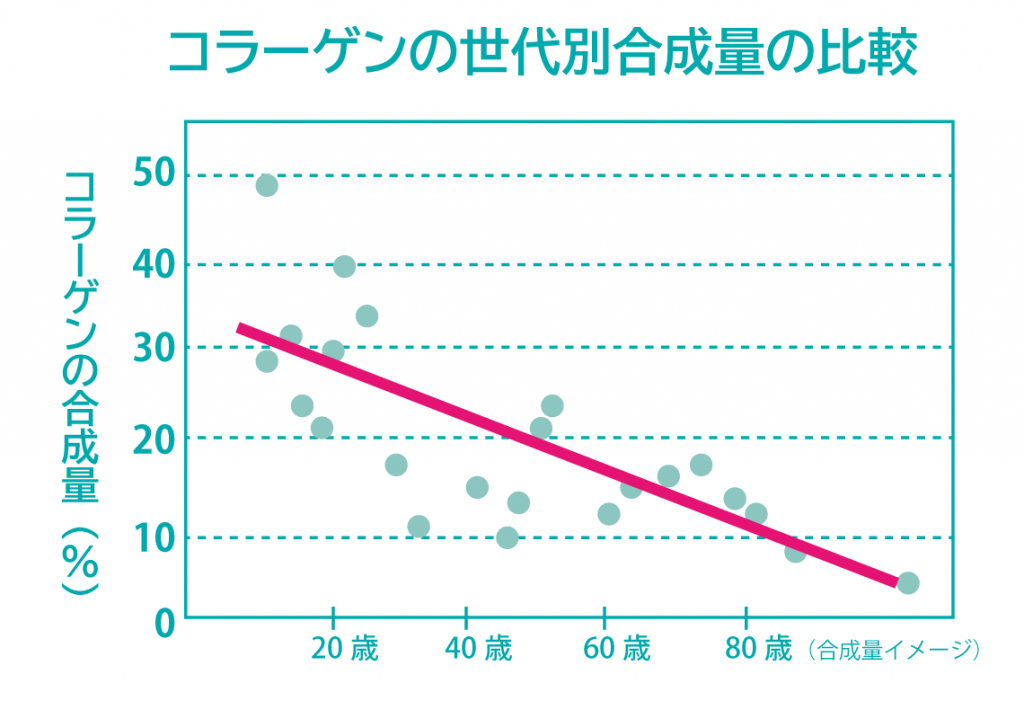
ファイバープロテインの機能
骨と軟骨の弾力性
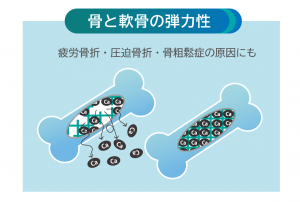
強い骨は、しなり戻り率が高く、ねばりがあるのが特徴。硬いだけでは、圧力を吸収できず折れやすくなる。骨を鉄筋コンクリートに例えると、コラーゲンが鉄筋でカルシウムがコンクリート。骨密度の低下は、骨内のコラーゲンが減少し、カルシウムを保持できず起こる。
筋膜と筋肉の伸縮性

筋肉をつつむ筋膜は、スムーズな筋肉の動きを支えている。過度な筋収縮は、筋膜との間に摩擦が発生し炎症の原因に。
筋膜の柔軟性や保水力の維持が、筋肉損傷や肉離れなどのリスクを低下させる。
血管の圧力の吸収性
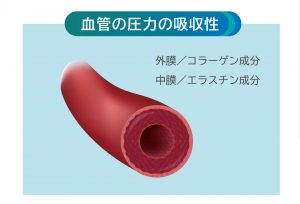
動脈は第2の心臓といわれ、その柔軟性や弾力性によって、急激な血流を吸収し、血圧や脈拍の安定をサポートする。
それはコラーゲンとエラスチンの機能でそれらの減少が血管力を低下させる。

靭帯と腱の強靭性と弾力性
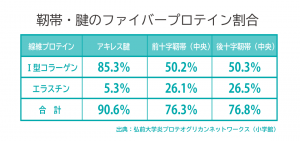
強靭や腱の主要成分は、コラーゲンとエラスチン。骨同士をつなぐ靭帯には伸縮性があり、激しい運動時でも関節を安定させる。そのためエラスチン割合が多い。筋肉と骨をつなぐ腱は、筋収縮の力を骨に伝える強靭性が求められる。そのためコラーゲンの構成割合が多い。
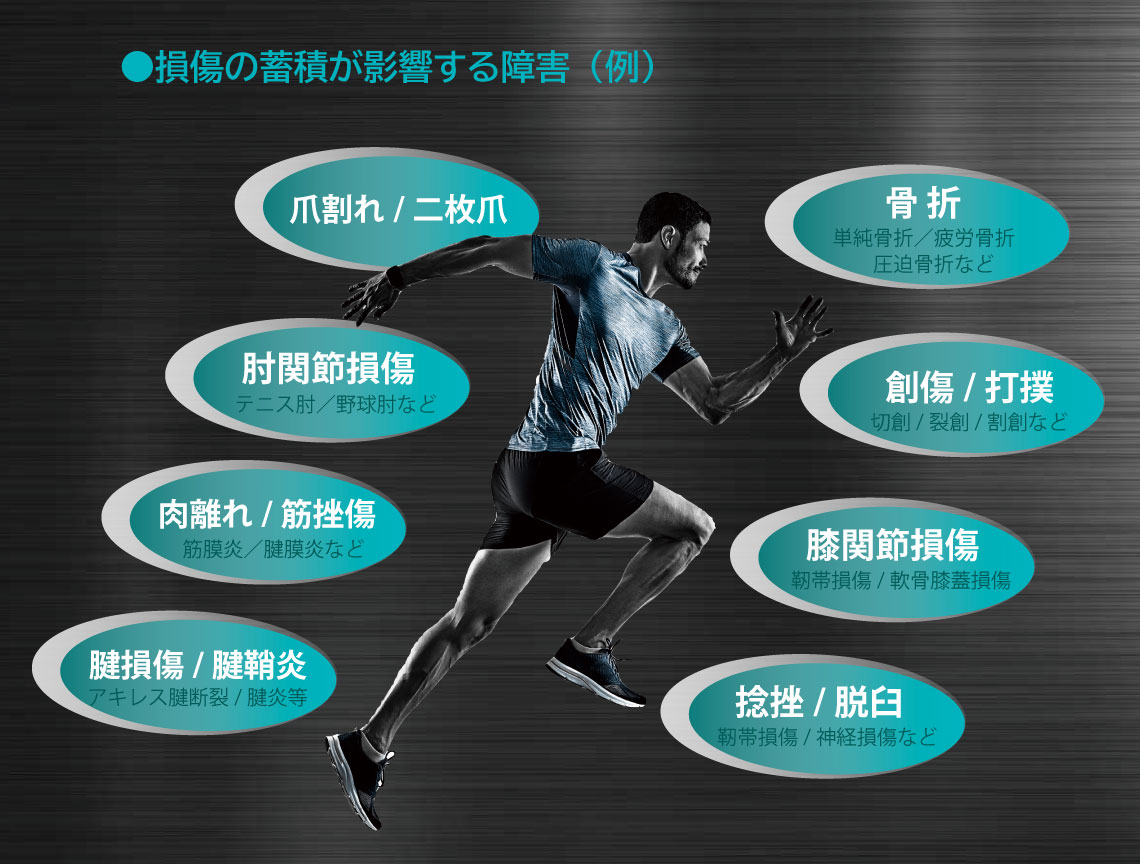
靭帯が硬くなり断裂リスクが増大

過度な運動、加齢、ホルモン変化、過度なストレスなどで、体内のファイバープロテイン量が減少し、正常に形成されないと硬化し脆くなる。靭帯や腱の損傷蓄積・断裂リスク、筋膜障害、動脈硬化、肺機能の低下、関節の可動域減少、肌のたるみなどの原因に。

ファイバープロテインが必要な理由
●損傷の修復促進
ファイバープロテインは、骨軟骨・靭帯・腱・血管などの損傷の修復促進が期待されている。
●障害の回復促進
折、肉離れ、靭帯損傷やアキレス腱断裂などのスポーツ障害の回復促進が期待されている。
●ケガの減少
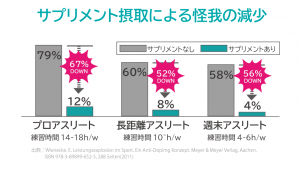 Ⅰ型コラーゲンを含むサプリメントを摂取したところ、2年間でプロアスリートのケガの発症率が67%、週末アスリートでも54%減少したと報告されている。
Ⅰ型コラーゲンを含むサプリメントを摂取したところ、2年間でプロアスリートのケガの発症率が67%、週末アスリートでも54%減少したと報告されている。
●筋疲労の回復
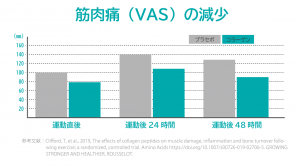 コラーゲンペプチドを摂取することで、筋肉痛が緩和され運動後の疲労回復時間を短縮したほか、パフォーマンスが向上したと報告されている。
コラーゲンペプチドを摂取することで、筋肉痛が緩和され運動後の疲労回復時間を短縮したほか、パフォーマンスが向上したと報告されている。
ファイバープロテインを経口摂取することで、運動機能の維持・向上、ケガリスクの減少、ケガの早期回復、持久力やコンディションのサポートなどが期待される。
【参考文献一覧】
- Koyama Y et al. Ingestion of gekatin has differential effect on bone mineral density and dody weight in protein undemutrition. J Nutr Sci Vitaminol 47:84-86 (2001)
- 田中, 佐藤。コラーゲン・ゼラチン摂取と骨強度。食品と開発 36:58-60 (2001)
- 石見ら。コラーゲンぺプチド摂取がラット生体に及ぼす影響。Osteopor Jap 11:212-214 (2003)
- Adam M et al. Postmanopausal osteoporosis. Treatment with calcitonin and a diet rich in collagen proteins. Cas Lek cesk 135:74-78 (1996)
- 皮膚角層の吸水能と血液生化学検査に対するコラーゲンペプチド経口摂取の作用。健康・栄養食品研究 7:45-52 (2004)
- Moganti P et al. Oral treatment of skin dryness. Cosmet Toilet 103:77-80 (1988)
- Rosenberg S et al. Further studies in the use of gelatin in the treatment of brittle nails. Arch Dermat & Syph 76:330-335 (1957)
- Schwimmer M and Mulinos MG. Salutary effects of gelatine on nail defects in normal subject. Antibio Med Clin Ther 4:403-407 (1957)
- Scala J et al. Effect of daily gelatine ingestion on human scalp hair. Nut Rep Int 13:579-592 (1976)
- Ratnayake WMN et al. Influence of dietary protein and fat and on serum lipids and metabolism of essential fatty acids in rats. Brit J Nutr 78:459-467 (1997)
- Oliveira DR et al. Gelatine intake infceases the atheroma formation in apoE knock out mice. Atheroscler 154:71-77 (2001)
- Moskowiz RW. Role of Collagen Hydrolysate in Bone and Joint Disease. Semin Arth Rheum 30:97-99 (2000)
- Minaguchi et al., Effects of ingestion of collagen peptide on collagen fibrils and glycosaminoglycans in Achilles tendon. J Nutr Sci Vutaminol 51:1699174 (2005)
- Matsuda et al., Effects of ingestion of collagen peptide on collagen fibrils and glycosaminoglycans in the dermis. J Nutr Sci Vutaminol 52:211-215 (2006)
- Prockop DJ, Keiser HR, Sjoerdsma A. Gastrointestinal absorpton and renal excretion of hydroxyproline peptides. Lancet Ⅱ:527-528 (1962).
- Iwai et al., Identification of food-derived collagen peptides in human blood after oral ingestion of gelatin hydrolysates. J Agric Food Chem 53:6531-6536 (2005)
- 小林、野口、小山。食事由来のコラーゲン摂取量の調査(第二報)。各年代の女性の摂取量について。第63回日本栄養・食糧学会。長崎(2009)
- Tanaka et al. Effects of collagen peptide ingestion on UV-B-induced skin damage. Biosci Biotechnol Bipchem 73:930-932 (2009)
- 小山洋一.コラーゲンの肌への作用・最新研究。食と開発 44:10-12 (2009)
- Prockop et al. Gastrointestinal absorptine and renal excretion of hydroxyproline peptides. Lancet Ⅱ:527-528 (1962)
- Shigemura et al. Effect of prolyl-hydroxyproline (Pro-Hyp), a food derived collagen peptide in human blood, on growth of fibroblasts from mouse ckin. J Agric Food Chem 57:444-449(2009)
- Rose et al. Dietary glycine inhibits the growth of B16 melanoma tumors in mice. Carcinogenesis 20:793-798 (1999)



